REVISTA DE INMUNOALERGIA
REVISTA DE
INMUNOALERGIA
El cuadro clínico del
SCH es característico y comprende manifestaciones dermatológicas que van desde
una dilución pigmentaria moderada de la piel y el cabello, hasta una
hipopigmentación severa comparable al albinismo óculo-cutáneo tirosinasa
positiva. Se puede presentar hiperpigmentación en áreas expuestas al sol.
Además: fotofobia, infecciones recurrentes piógenas severas en la piel y aparato
respiratorio, deterioro neurológico gradual con retardo mental, convulsiones,
neuropatía periférica y debilidad muscular. Luego de varios años de evolución,
la enfermedad presenta en el 85% de los casos episodios agudos, denominados
“fase acelerada” similares a un linfoma, y se caracterizan por la infiltración
visceral del hígado y el bazo por linfocitos atípicos e histiocitos, con
hepatoesplenomegalia, poliadenopatías, ictericia, pancitopenia y
gingivoestomatitis. Por la trombocitopenia, se encuentran petequias y equimosis
(16) (Foto 9).
Granulomas cutáneos
Enfermedad Granulomatosa Crónica
(EGC)
La EGC es causada por un
defecto profundo en la explosión respiratoria que acompaña a la fagocitosis de
todas las células mieloides (neutrófilos, eosinófilos, monocitos, macrófagos).
Durante la explosión respiratoria se produce la conversión catalítica del
oxígeno molecular (O2) en anión superóxido
(O-2), el cual se convierte en peróxido de
hidrógeno (H2O2),
ácido hipocloroso y radicales hidroxilo (.OH);
estos derivados del O2 son importantes
para la reacción microbicida contra bacterias y hongos. El complejo enzimático
que cataliza la explosión respiratoria se conoce como NADPH oxidasa, compuesto
por lo menos por cuatro proteínas, dos se encuentran en la membrana plasmática,
las subunidades del citocromo b558, la
gp91-phox y la p22-phox, (phox: oxidasa de los fagocitos), y dos proteínas
citosólicas, la p47-phox y la p67-phox (23).
|

Foto 9. Síndrome de Chediak-Higashi. Albinismo moderado del
cabello y marcada hiperpigmentación de la cara. |
El defecto molecular en
la EGC es bastante heterogéneo y se origina a partir de las mutaciones en
cualquiera de los cuatro genes que codifican para las proteínas del sistema.
Así, mutaciones localizadas en el gen que codifica para la gp91phox (ubicado en
el cromosoma X, Xp21-1) producen la variedad ligada al sexo que afecta el 60% de
todos los pacientes. El otro 40%, se transmite como un rasgo autosómico recesivo
debido a que los genes que codifican para p47phox, p67 phox y p22 phox se
encuentran en los cromosomas somáticos.
La principal
característica clínica de la EGC es la aparición en el primer año de vida del
síndrome de infección recurrente anormal con compromiso de la piel, los aparatos
gastrointestinal y respiratorio, los ganglios y algunos órganos profundos como
el hígado. En la piel, las manifestaciones más frecuentes son las infecciones
por Staphylococcus aureus: piodermitis, forunculosis, abscesos, granulomas
cutáneos; fístulas perianales; úlceras crónicas por fistulización de una
adenitis supurada a nivel del cuello, gingivoestomatitis crónica, úlceras orales
y una dermatitis similar a la atópica (4, 16, 24, 25) (Foto 10).
|
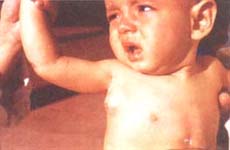
Foto 10. Enfermedad granulomatosa crónica. Granuloma cutáneo en
tercio superior del tórax. |
Con frecuencia se
presentan: neumonía, osteomielitis, enfermedad diarreica recurrente o crónica,
septicemia y hallazgos no infecciosos como la hepatoesplenomegalia y las
adenopatías múltiples.
Las mujeres
heterocigóticas portadoras de mutaciones para la EGC ligada al cromosoma X no
tienen un riesgo anormal de infecciones, pero pueden presentar un lupus discoide
o sistémico y afecciones de la cavidad oral como estomatitis aftosa y queilitis
granulomatosa (16).
Infecciones cutáneas por Candida albicans
Candidiasis Mucocutánea Crónica
(CMC)
La CMC es una
inmunodeficiencia de origen desconocido que se inicia por lo general en los
primeros años de la vida, pero existen también casos en la vida adulta. Se
caracteriza por una susceptibilidad anormalmente elevada a las infecciones de la
piel y las mucosas por Candida albicans, que rara vez se acompaña de
compromiso sistémico o de infecciones por otros microorganismos (hongos y
bacterias). En algunos casos se asocia con endocrinopatías como el
hipotiroidismo, el hipoparatiroidismo, la disfunción gonadal y el
hipoadrenalismo. La presencia de autoanticuerpos dirigidos contra diferentes
órganos endocrinos ha llevado a proponer una etiología autoinmune (26).
En los pacientes con CMC
las diferentes subpoblaciones de LT son normales, pero las pruebas de
hipersensibilidad retardada para Candida albicans son negativas. La función de
los LB y la producción de anticuerpos específicos está conservada.
La intensidad de las
lesiones varía en cada paciente y se observa desde moderado compromiso de las
uñas o la mucosa oral hasta formas difusas con gran hipertrofia de las mucosas y
formación de granulomas en la piel y en las uñas (16) (Foto 11).
Infecciones virales de la piel
Inmunodeficiencia celular con
inmunoglobulinas y anticuerpos normales
Es una inmunodeficiencia
primaria de origen molecular desconocido,
en la cual se aprecia una disminución profunda y sostenida en el número
de LT CD4+ circulantes. Se afectan además
los LB y las células NK, pero los granulocitos son normales (2, 27).
|

Foto 11. Candidiasis mucocutánea crónica. Lesiones crónicas por
Candida albicans en labios y mucosa yugal. Queilitis angular.
Lesiones granulomatosas crónicas con destrucción de uñas de los
dedos. |
Los síntomas se
presentan en la pubertad con afecciones por papilomavirus, los cuales producen
verrugas extensas diseminadas y resistentes a todo tipo de tratamiento, en
ocasiones semejan una epidermodisplasia verruciforme. Además, manifiestan
infecciones por gérmenes intracelulares como la meningitis por Cryptococcus
neoformans, la tuberculosis pulmonar y miliar, la neumonía por
Pneumocystis carinii, y las infecciones mucocutáneas y diseminadas por
Candida albicans. En estos pacientes no se observan infecciones por
bacterias extracelulares porque tienen normales los niveles de inmunoglobulinas
séricas y la producción de anticuerpos específicos está conservada (28) (Foto
12).
Reacciones inflamatorias agudas de la piel
y las mucosas
Edema Angioneurótico Hereditario (EAH)
El EAH es una enfermedad
autosómica recesiva generada por la deficiencia de una de las proteínas
reguladoras del complemento conocida como Inhibidor de la C1 esterasa (C1INH),
la cual es codificada por un gen localizado en el cromosoma 11 (29).
La C1INH se encuentra
normalmente en bajas concentraciones en el suero y controla la activación
espontánea de las enzimas C1r y C1s al unirse en forma covalente a ellas e
impedir la formación de un complejo C1
macromolecular activo. Además, el C1INH controla la actividad de otras
proteínas como el C2, el C4 y el Factor de Hageman.
|
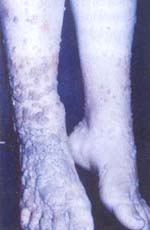
Foto 12. Inmunodeficiencia
celular con inmunoglobulinas y anticuerpos normales. Extensas
lesiones de verrugas planas, confluentes (semejante a la
epidermodisplasia verruciforme), en piernas y pies. |
En ausencia del C1INH, aún con traumas mínimos se induce la
cascada de la coagulación con la activación del factor de Hageman y las
calicreínas, para generar sustancias vasoactivas que producen el angioedema.
Éste se puede localizar en áreas cutáneas y mucosas, pero es más frecuente en la
piel de la cara produciendo un edema severo de ella, los párpados y los labios;
ocasionalmente hay compromiso laringofaríngeo que obstruye las vías aéreas y
puede causar la muerte. El angioedema es indoloro, no hay prurito ni signos
inflamatorios, y generalmente desaparece en 2 a 4 días. Cuando compromete la
mucosa digestiva se presenta con dolor abdominal recurrente (Foto 13).
|
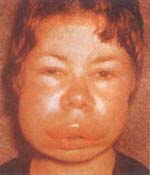
Foto 13. Angioedema hereditario (Deficiencia C1INH). Angioedema
severo que compromete: párpados, cara y labios. |
Este tipo de angioedema
no responde al tratamiento con antihistamínicos, esteroides ni
antiinflamatorios generales, solo mejora con terapia basada en sustancias que
incrementan la síntesis hepática del C1INH.
Correspondencia: Diana García de Olarte. AA. 1226 de
Medellín. Teléfono: 510 60 57. Email: [email protected] .co
REFERENCIAS BIBLIOGRÁFICAS
1. Smith CIE, Ochs HD, Puck JM. Genetically
Determined Immunodeficiency Diseases: A Perspective. In: Ochs HD, Smith CIE,
Puck JM, eds. Primary immunodeficiency diseases. A Molecular and Genetic
Approach. New York: Oxford University Press, 1999:3-11.
2. WHO Scientific Group. Primary Immunodeficiency
Diseases. Clin Exp Immunol 1997;109 (suppl. 1):1-28.
3. Latinoamerican Group of Primary Immunodeficiency
Diseases (LAGID). Clasificación fenotípica de las inmunodeficiencias
primarias. Boletín LAGID 1997;1:11-13.
4. García de
OD, Patiño PJ, Salgado H, López JA, Montoya CJ, Pérez JE. Evaluación del
paciente con inmunodeficiencia. Síndrome de infección recurrente patológica.
Medicina y Laboratorio 1997;7:545-575.
5. García de
OD. Que tan lejos se ha llegado en el conocimiento de las inmunodeficiencias
primarias. Rev Asoc Colomb Alerg Asma e Inmunol 2000;9:51-61.
6. Grimbacher B, Holland SM, Gallin JI, et al.
Hyper-IgE Syndrome with recurrent infections. An autosomal dominant multisystem
disorder. N Engl J Med 1999;340:692-702.
7. Buckley RH. Disorders of the IgE system. In:
Stiehm RE, ed. Immunologic disorders in infants and children. 4th ed.
Philadelphia: WB Saunders Company, 1996:409-422.
8. Montoya CJ,
García de OD, Butler B, Leiva LE, Rodríguez J, Sorensen RU.
Abnormal IgG antobidy response to Streptococcus pneumoniae polysaccharide and
defective immunological memory in patients with the Hyper-IgE recurrent
infection syndrome. (Sometido para publicación en Journal of Clinical
Immunology).
9. Montoya CJ,
García de OD, Butler B, Leiva LE, Sorensen RU. Cytokine and
CD40 ligand mRNA expression by resting and stimulated peripheral blood
mononuclear cell of patients with the Hyper-IgE recurrent infection syndrome.
(Manuscrito en preparación).
10. Geha RS, Leung DYM. Hyper immunoglobulin E
syndrome. Immunodef Rev 1989;1:155-172.
11. Borges WG, Hensley T, Carey JC, Petrak BA, Hill
HR. The face of Job. J Pediatr 1998;133:303-305.
12. Buckley RH, Schiff IR, Schiff SE, et al. Human
severe combined immunodeficiency: Genetic, phenotypic, and functional diversity
in one hundred eigth infants. J Pediatr 1997;130:378-387.
13. IUIS Scientific Group. Primary Immunodeficiency
Diseases. Clin Exp Immunol 1999;118 (Suppl. 1):1-28.
14. Schwarz K, Notarangelo LD, Spanopoulou E,
Vezzoni P, Villa A. Recombination Defects. In: Ochs HD, Smith CIE, Puck JM,
eds. Primary immunodeficiency Diseases. A Molecular and Genetic Approach. New
York: Oxford University Press, 1999:155-166.
15. Stephan JL,
Vlekova V, Le Deist F, et al. Severe Combined
Immunodeficiency: A retrospective single-center study of clinical presentation
and outcome in 117 patients. J Pediatr 1993;123:564-572.
16. Paller AS. Cutaneous Changes in Disorders of
Altered Reactivity. Genetic Immunodeficiency Diseases. In: Freedberg I, Eisen A,
Wolff K, Austen F, Goldsmith L, Katz S, Fritzpatrick T, eds. Fritzpatrick’s
Dermatology in General Medicine. 5th ed. New York: McGraw-Hill, 1999:1397-1408.
17. Etzioni A,
Harlan JM. Cell Adhesion and Leukocyte Adhesion Defects. In:
Ochs HD, Smith CIE, Puck JM, eds. Primary immunodeficiency Diseases. A Molecular
and Genetic Approach. New York: Oxford University Press, 1999:375-388.
18. Rosen FS, Geha RS. Leukocyte Adhesion
Deficiency. In: Rosen FS, Geha RS, eds. Case Studies in Immunology. A Clinical
Companion. Second ed. New York: Current Biology Publications - Garland
Publishing, 1999:87-94.
19. Ochs HD, Rosen FS. The Wiskott-Aldrich Syndrome.
In: Ochs HD, Smith CIE, Puck JM, eds. Primary immunodeficiency Diseases. A
Molecular and Genetic Approach. New York: Oxford University Press, 1999:292-305.
20. Lavin MF, Shiloh Y. Ataxia-Telangiectasia.
In: Ochs HD, Smith CIE, Puck JM, eds. Primary immunodeficiency Diseases. A
Molecular and Genetic Approach. New York: Oxford University Press, 1999:305-323.
21. Cohen LE, Tanner DJ, Schaefer
HG, Levis WR. Common and uncommon cutaneous findings in patients with ataxia-telangiectasia.
J Am Acad Dermatol 1984;10:431-438.
22. Spritz RA. Chediak-Higashi
Syndrome. In: Ochs HD, Smith CIE, Puck JM, eds. Primary immunodeficiency
Diseases. A Molecular and Genetic Approach. New York: Oxford University Press,
1999:389-396.
23. Segal BH, Leto TL, Gallin JI,
Malech HL, Holland SM. Genetic, Biochemical, and Clinical Features of Chronic
Granulomatous Disease. Medicine 2000;79:170-200.
24. Winkelstein JA, Marino MC,
Johnston RB, et al. Chronic Granulomatous Disease. Report on a National Registry
of 368 Patients. Medicine 2000;79:155-169.
25. Dohil M, Prendiville JS,
Crawford RI, Speert DP. Cutaneous manifestations of chronic granulomatous
disease. J Am Acad Dermatol 1997;36:899-907.
26. Hong R, Clement LT, Gatti RA,
Kirkpatrick CH. Disorders of the T-cell System. In: Stiehm ER, ed. Immunologic
Disorders in Infants and Children. Philadelphia: W.B. Saunders Company,
1996:339-408.
27. Latinoamerican Group of
Primary Immunodeficiency Diseases (LAGID). Clasificación fenotípica de
las inmunodeficiencias primarias. Boletín LAGID 1997;1:11-13.
28. Lowy DR, Androphy EJ. Wartz.
In: Freedberg I, Eisen A, Wolff K, Austen F, Goldsmith L, Katz S, Fritzpatrick
T, eds. Fritzpatrick’s Dermatology in General Medicine. 5th ed. New York:
McGraw-Hill, 1999:2484-2497.
29. Sullivan KE, Winkelstein JA.
Genetically Determined Deficiencies of the Complement System. In: Ochs HD, Smith
CIE, Puck JM, eds. Primary immunodeficiency Diseases. A Molecular and Genetic
Approach. New York: Oxford University Press, 1999:397-417.